ガス主任技術者の試験で何と言っても確実に点数を取れるのは基礎理論です。

わたしは文系の人間で、数学は数Ⅰと数ⅡB止まり。それも何十年も前の事で
ほとんど覚えていません。
それでも何とかなり、結果として基礎で救われました。
基礎は他の科目と違って合っている答えを一つ選ぶだけですから、その問題を理解していれば絶対に正解でき、点数をゲットできるのです。
チャレンジする皆さんはもちろんご存じでしょうが、テストの出題数15問のうち、10問選択ですから、確実に分かっている10問を選択すれば、全問正解となり、基礎だけで50点を得ることができます。

では、わたしのように理系の知識ほぼゼロという方向けに、ここから?という所から説明にはいりますので、理解てきている方は必要なところまで飛ばしてお読みください。
 |
甲種ガス主任技術者試験模擬問題集(2022年度受験用) ポケット版 [ 上井光裕 ] 価格:2,649円 |
 |
乙種ガス主任技術者試験模擬問題集(2022年度受験用) ポケット版 [ 上井光裕 ] 価格:2,585円 |
本当に理科的なものが苦手な方はこちらを先ず覚えましょう!
これはもう必須 化学・物理の基礎の基礎
周期表を必要な部分だけ覚える
| 1 H 水素 | 2 He ヘリウム | ||||||||||||||||
| 3 Li リチウム | 4 Be ベリリウム | 5 B ホウ素 | 6 C 炭素 | 7 N 窒素 | 8 O 酸素 | 9 F フッ素 | 10 Ne ネオン | ||||||||||
| 11 Na ナトリウム | 12 Mg マグネシウム | 13 Al アルミニウム | 14 Si ケイ素 | 15 P リン | 16 S 硫黄 | 17 Cl 塩素 | 18 Ar アルゴン | ||||||||||
| 19 K カリウム | 20 Ca カルシウム |
H(水素)からCa(カルシウム)までを覚える方法です。
もし覚えていない方は、下記の語呂で覚えましょう!
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
水兵 リーベ 僕の船 そー曲がる シップスクラークか
※「そー」は「Na」です。ナトリウムはドイツ語、ソーダは英語です。
表の上の数字は原子番号、下は元素記号です。
これを覚えて置けば、原子や分子の質量(重さ)が分かります。
大体ですが、質量数は原子番号の2倍であることが多いからです。(塩素は、35ですが)
原子量・分子量・分子式・モルとアボガドロの法則について
原子量について
原子や分子には質量があるのですが、その質量はすごーく小さいものです。
ですので、炭素原子(これはガスでは一番お世話になる元素ですよね)の質量を12として、他の原子の質量を相対的に表したもので、単位はありません。
H水素は1・・・C炭素は12、N窒素は14、O酸素は16・・・S硫黄は32、Cl塩素は35となります。
分子量、分子式について
水の分子はH2Oです。このH2Oを分子式といいます。
分子量はH…1 O…16 なので (1×2)+16=18 です。
では、メタンCH4、エタンC2H6、プロパンC3H8、ブタンC4H10の分子量はいくつでしょうか?
ちなみにメタンCH4、エタンC2H6、プロパンC3H8、ブタンC4H10の分子式は覚えてください。
| メタン 12+(1×4)=16 エタン (12×2)+(1×6)=30 プロパン(12×3)+(1×8)=44 ブタン(12×4)+(1×10)=58 となります |
モルについて
炭素原子Cの12g(今度は12グラムです)の中に含まれる原子の数は約6×1023個 あり、これを
アボガドロ数と言います。
このアボガドロ数6×1023個の合計質量を1モル(mol)といいます。
なので、炭素1モルは12g、水1モルは18g、メタン1モルは30g、プロパン1モルは44gとなります。
アボガドロの法則について

すごいですね、アボガドロさん。
1811年に、こんなすごいことを発見なさるなんて!

まだまだ先は長いですが、基礎理論編について私の理解できたところまで徐々にお伝えしたいと思います。
圧力とエネルギーと力の関係
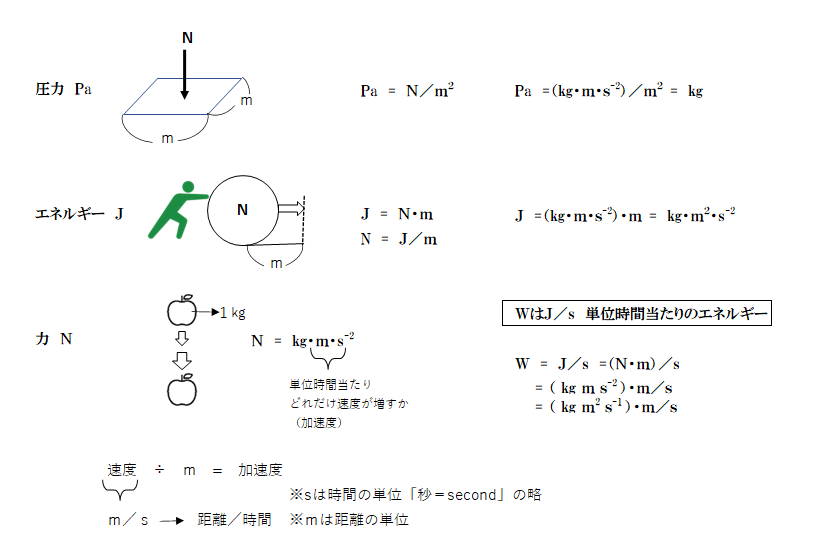
上の図で、圧力とエネルギー、力の関係を整理しておくと良いと思います
気体の基本的な諸性質から
ボイルの法則・シャルルの法則・ボイルシャルルの法則
■■ボイルの法則■■
温度が一定であれば、気体の体積Vは圧力Pに反比例する。 PV=一定
体積を増やせば圧力は下がるし、体積をぐっと縮めれば圧力は上がる。
P圧力(pressure) V体積(volume)
■■シャルルの法則■■
圧力が一定なら気体の体積は温度が1℃上がるごとに0℃における体積の1/273.15ずつ増大する。
V=V0(273.15+t)/273.15
この式によればt=-273.15℃(絶対温度 T[K])で体積Vは0となる。
V=V0×T/273.15
すなわち
V/T=一定
圧力が一定であれば、気体の体積Vは絶対温度Tに比例する
※絶対温度T[K]とセルシウス温度t[℃]は T=t+273[K]となります。
tセルシウス温度 T絶対温度 温度(temperature)
■■ボイル・シャルルの法則■■
一定の質量の気体の体積は圧力に反比例し、絶対温度に比例する。
PV/T=一定
問題が℃(セルシウス温度)の時には絶対温度に直すことをお忘れなく!
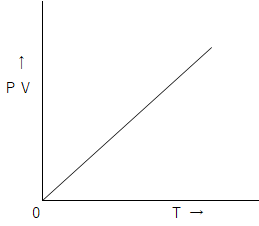
■■ボイル・シャルルの関係式■■
PV/T=nR またはPV=nRT
nはモル数 Rは気体定数で、気体の種類によらず一定 R=8.314J/(mol・K)
アボガドロの法則:気体は同じ温度、同じ圧力のとき同じ体積の中に同数の分子が存在する
0℃、標準大気圧101.325kPaで1molの気体分子は、22.414Lの体積を占める
ドルトンの分圧の法則
混合気体全体の圧力(全圧)Pは、各成分気体の分圧の和に一致する。
P=pA+pB A(nA mol)とB(nB mol)の混合気体の分圧pAとpB の和に一致
混合気体において各成分の分圧は全圧にモル分率をかけたものに等しい
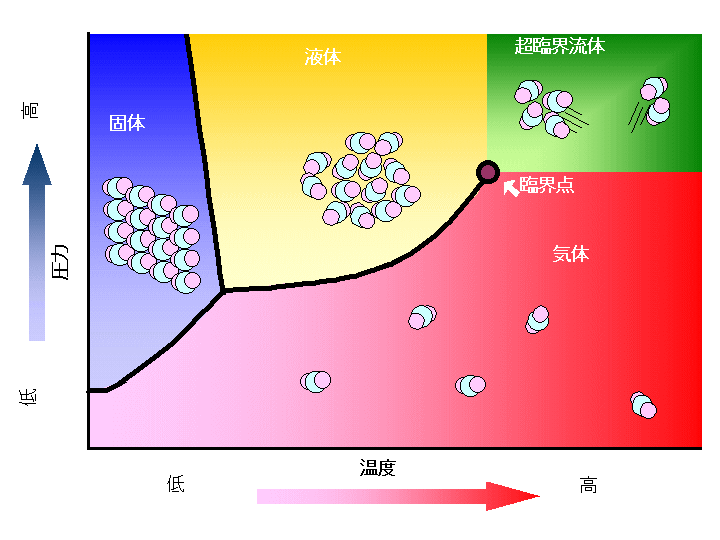
臨界現象
二酸化炭素CO2を等温的に圧縮し始めると(A点)、体積が減少していく。
更に圧縮していくと液化が一部始まり(B点)、それ以降圧力が一定で液化が進む。
圧縮し続けると全部液化する(C点)。
全て液化してしまうと、液体は圧縮しにくいため、その後は圧力は増加しても体積の減少は小さい。
BC間では圧力が一定で、グラフでは圧力が一定で水平線となり気体と液体が共存している。
この温度に固有の気相、液相の二相共存の時の圧力を飽和蒸気圧という。
上記の水平線の部分は等温である温度を上げていくと短くなり、二酸化炭素CO2は31.1℃で消失する。
この点Kを臨界点と呼び、この時の温度Tcを臨界温度、圧力Pcを臨界圧力、密度ρcを臨界密度、体積Vcを臨界体積という。
臨界温度以上では、圧力をどんなに上げても期待を液化することはできない。
CO2(二酸化炭素)、NH3(アンモニア)、SO2(二酸化硫黄)などは臨界温度が比較的高いので、常温で圧力を加えるだけで液化することができる。
メタン(CH4)の臨界温度は-82.6℃であるから天然ガスをLNG(液化天然ガス)にする場合はこの温度以下にする必要がある。
熱伝導率
温度の高いところから低いところへ熱が移動することを熱伝導といい、熱の伝わり易さを熱伝導率で表す
q=λ(T1-T2)/l ※ λはギリシア文字でラムダと読みます
q:熱流束[W/m2] T1:高温側温度[K] T2:低温側温度[K]
λ:熱伝導率[W/m・K] l:二面間の距離[m]
※熱流束とは熱流束 (ねつりゅうそく)とは、 流束 のひとつで、単位時間に単位面積を横切る 熱量のこと 熱の伝わり易さのことですね
熱伝導率が大きければ熱は伝わり易く、小さければ伝わりにくい。
気体の熱伝導率は液体や固体に比べてかなり小さいことから断熱効果が大きい。
気体の熱伝導率は、温度の上昇と共に増加する。
粘度
液体や気体が流動するとき各部分が互いに抵抗しあう性質を粘性といい、その程度を粘度という。
気体の粘度は液体の粘度に比べて小さく、温度とともに増加し、圧力によってはほとんど変わらない。
液体の粘度は温度上昇により低下し、気体の粘度は温度上昇により上昇する。
それは、温度上昇により分子運動が活発になっているにも関わらず、衝突により速度を変じられることが原因。
溶解度
液体中に気体、液体、個体が溶けて均一な状態の液体を形成することを、溶解という。
溶解する物質を溶質、溶解させる物質を溶媒と呼ぶ。
ヘンリーの法則
溶解度が小さい場合、一定の温度で一定質量の液体に溶解する気体の質量は、気体の圧力に比例する
P=H・x
P:気体の圧力 H:ヘンリー定数[Pa] x:気体(溶質)のモル分率

押せば溶ける。圧力が2倍なら2倍溶けるということですよね
拡散
温度および圧力の等しい気体AとBが壁で分けられているとして、その壁を取り去ると、AとBの気体の濃度がどこをとっても同じ状態となる。この過程を拡散という。
分子量の小さい気体ほど(Hとか軽いから)拡散係数が大きくなる。
このためメタン、エタン、プロパンと分子量が大きくなるにつれて拡散速度は小さくなる。
気体の熱力学
熱力学第一法則
●熱と仕事は等価であり、エネルギーの一形態である
●系の保有するエネルギーは、外界との間に出入がない限り一定であり、外界との間に出入があれば、出入した量だけ減少または増加する
●第一種永久機関(外部からのエネルギー入力なしに、外部に仕事をし続ける機関)は不可能
エンタルピー
エンタルピーは内部エネルギーに圧力と体積の積を加えた量
H = U + PV
エンタルピー = 内部エネルギー + 圧力×体積
等温変化
PV=k(一定) 圧力×体積=一定
理想気体の等温変化では系の温度は一定であるから内部エネルギーは0

“系”っていきなり出てくるんですけど💧何だろうと調べました。
下記の通り、wikipediaにでております。
続きとして熱力学的な分類というところで、何だかテキストで読んだような言葉がでてきております。
要するに考察する目的として注目している同系列の物質達みたいなものでしょうか
自然科学における系(けい、英語: system)とは、自然界のうちで考察の対象として注目している部分をいう。分野や考察の内容に応じて力学系、生態系、太陽系、実験系などというように用いられる。考察の対象とされない部分は外界(英語版)として区別される。
引用:wikipedia
断熱変化
dU=-dW U:内部エネルギー W:仕事
断熱変化は系と周囲との間に熱移動の無い家庭であるから、状態変化は仕事だけに関係する
断熱膨張は温度の降下をきたし、断熱圧縮は温度の上昇を伴う
熱力学第二法則
●仕事(機械的エネルギーおよび熱を除く各種エネルギー)は、それらを常に完全に熱に変えることができる。しかし、熱を完全に仕事に変えることはできない
●第二種永久機関(ただ一つの熱源から熱をうけて仕事をするたけで、その他に何らの作用もなさずに周期的に働く機関)は不可能である
エントロピー
dS = dQrev / T
S:エントロピー d:微小 Q:熱量 T:絶対温度
エントロピーは、熱力学第二法則が示す変化の方向性を定量化する状態量
エントロピーは状態量であるから、ある系の現在のエントロピーはその状態のみによって決まり、それがどのような経路で到達したかには無関係である
熱力学第三法則
●絶対温度0Kで、全ての純物質の結晶のエントロピーは0である
●標準状態(105Paまたは101325Pa)におけるエントロピーを標準エントロピーと呼び、その値は常に正(温度T>0Kにおいて)となる
カルノーサイクル
●カルノーサイクルは最大の仕事を取り出すことのできる理想的な熱機関の一例
●カルノーサイクルは二つの等温過程と二つの断熱過程からなる。
η = W / Q12 = (Q12 -Q34) / Q12 ※ηはギリシア文字でイータと読みます
η:熱効率 W:仕事 Q12:高熱源の熱 Q34:低熱源の熱
η = (Q12 -Q34) / Q12 = (TH - TL)/ TH
TH:高熱源の温度 TL:低熱源の温度
効率は高熱源の温度と低熱源の温度だけで決まる(カルノーの定理)



コメント