ガス主任技術者の試験で何と言っても確実に点数を取れるのは基礎理論です。

ほとんど覚えていません。
それでも何とかなり、結果として基礎理論で救われました。
甲種の試験では、基礎は他の科目と違って合っている答えを一つ選ぶだけですから、その問題を理解していれば絶対に正解でき、点数をゲットできるのです。
チャレンジする皆さんはもちろんご存じでしょうが、テストの出題数15問のうち、10問選択ですから、確実に分かっている10問を選択すれば、全問正解となり、基礎だけで50点を得ることができます。

気体の熱力学
熱力学第一法則
●熱と仕事は等価であり、エネルギーの一形態である
●系の保有するエネルギーは、外界との間に出入がない限り一定であり、外界との間に出入があれば、出入した量だけ減少または増加する
●第一種永久機関(外部からのエネルギー入力なしに、外部に仕事をし続ける機関)は不可能
エンタルピー
エンタルピーは内部エネルギーに圧力と体積の積を加えた量
H = U + PV
エンタルピー = 内部エネルギー + 圧力×体積
等温変化
PV=k(一定) 圧力×体積=一定
理想気体の等温変化では系の温度は一定であるから内部エネルギーは0

“系”っていきなり出てくるんですけど💧何だろうと調べました。
下記の通り、wikipediaにでております。
続きとして熱力学的な分類というところで、何だかテキストで読んだような言葉がでてきております。
要するに考察する目的として注目している同系列の物質達みたいなものでしょうか
自然科学における系(けい、英語: system)とは、自然界のうちで考察の対象として注目している部分をいう。分野や考察の内容に応じて力学系、生態系、太陽系、実験系などというように用いられる。考察の対象とされない部分は外界(英語版)として区別される。
引用:wikipedia
熱力学第二法則
●仕事(機械的エネルギーおよび熱を除く各種エネルギー)は、それらを常に完全に熱に変えることができる。しかし、熱を完全に仕事に変えることはできない
●第二種永久機関(ただ一つの熱源から熱をうけて仕事をするたけで、その他に何らの作用もなさずに周期的に働く機関)は不可能である
エントロピー
dS = dQrev / T
S:エントロピー d:微小 Q:熱量 T:絶対温度
エントロピーは、熱力学第二法則が示す変化の方向性を定量化する状態量
エントロピーは状態量であるから、ある系の現在のエントロピーはその状態のみによって決まり、それがどのような経路で到達したかには無関係である
熱力学第三法則
●絶対温度0Kで、全ての純物質の結晶のエントロピーは0である
●標準状態(105Paまたは101325Pa)におけるエントロピーを標準エントロピーと呼び、その値は常に正(温度T>0Kにおいて)となる
カルノーサイクル
●カルノーサイクルは最大の仕事を取り出すことのできる理想的な熱機関の一例
●カルノーサイクルは二つの等温過程と二つの断熱過程からなる。
η = W / Q12 = (Q12 -Q34) / Q12 ※ηはギリシア文字でイータと読みます
η:熱効率 W:仕事 Q12:高熱源の熱 Q34:低熱源の熱
η = (Q12 -Q34) / Q12 = (TH - TL)/ TH
TH:高熱源の温度 TL:低熱源の温度
効率は高熱源の温度と低熱源の温度だけで決まる(カルノーの定理)
化学反応と化学平衡
標準反応熱を求める問題
標準反応熱を求める問題で、下記の標準反応熱を求める
C6H6(l) + 15/2 O2(g) → 3H2O(l) + 6CO2(g)
ただし、各成分の標準生成熱は以下のとおりとする
C6H6(l):ΔH°f = 49.0kJ/mol C6H6(g):ΔH°f =82.6kJ/mol
H2O(l):ΔH°f =-285.8kJ/mol H2O(g):ΔH°f =-242.0kJ/mol
CO2(g):ΔH°f = -393.5kJ/mol O2(g):ΔH°f =0
! 矢印の右側から左側を引く
! (g)と(l)があるので、問題と同じ単位の標準生成熱を選ぶ
! プラスとマイナスに注意する
すると計算式は
3×(-285.8)+6×(-393.5)-(49.0+15÷2×0) となります
これを計算すると
-857.4-2361-49 = 3267.4kJ/mol です。
ル・シャトリエの原理
平衡状態にある反応系において、その状態に対して何らかの変動を加えた時、平衡が移動する方向を示す原理。
その変化を相殺する方向へ平衡は移動する。
温度の影響
化学平衡式で「+Q」は発熱反応、「-Q」吸熱反応で、温度を上昇させると、発熱反応は平衡式のっ右側に、吸熱反応は平衡式の左側に反応が進みやすくなる。
圧力の影響
圧力を上げるとモル数を減らす方向に、圧力を下げるとモル数を増やす方向に移動する。
右と左でモル数が同じ場合は、圧力の影響はない。
水蒸気比の影響
水蒸気とは、「+H2O」のことなので、水蒸気を増加すると「+H2O」の化学平衡式では反応は右に進む。
化学反応速度
温度一定の条件では、一次反応において、反応速度は反応物質の濃度に比例する
一次反応の半減期は反応物質の初濃度に無関係であり、速度定数のみにより決定される。
言い換えれば、反応のどの時点から測っても、その濃度が半分になるまでの時間は等しい。
【例題】一次反応において、反応物の濃度が、初期濃度a0から1/2a0になるまでに要した時間(半減期)が30分であった。初期濃度a0から1/8a0になるのに要する時間を求めよ。
出典:一般社団法人日本ガス協会 都市ガス工業概要(基礎理論編)より
**解答**
💧 難しい計算式は分からないので、
1/1ーー→1/2ーー→1/4ーー→1/8
←30分→ ←30分→ ←30分→ で計90分 答えは 90分
【ガス主任技術者 平成27年度 甲種基礎問題 問5】
1次反応において、反応物質の濃度が初期濃度a0からa0/2になるまでに要した時間(半減期)は30分であった。初期濃度a0から120分後の濃度は次のどれか。
(1) a0/4 (2) a0/8 (3) a0/12 (4) a0/16 (5) a0/24
**解答**
上記の方法で解くと
←30分→ ←30分→ ←30分→ ←30分→ で計120分
1/1ーー→1/2ーー→1/4ーー→1/8ーー→1/16 となるので
答えは (4) a0/16
燃焼および燃焼計算
気体燃料の性状
総発熱量・・・水蒸気の潜熱を含む発熱量
新発熱量・・・水蒸気の潜熱を含まない発熱量
💡おおよその総発熱量、真発熱量は化学反応式から計算によって割り出すことができます
ただし計算の数値と実際の熱量に開きがあるものもありますが
たとえばプロパンの総発熱量はプロパン1molに対し5molの酸素が必要となります(これを理論酸素量といいます)
酸素1㎥あたりの総発熱量を20MJとして計算すると、20×5で100MJとなり、本来の101.36MJと近い数値になります
真発熱量は、そこから水1㎥あたりの熱量2MJを差し引いて求めます
化学反応式により1molのプロパンでは4molの水が発生するので
100-(4×2)で92MJとなり、本来の93.15MJと近い数値になります
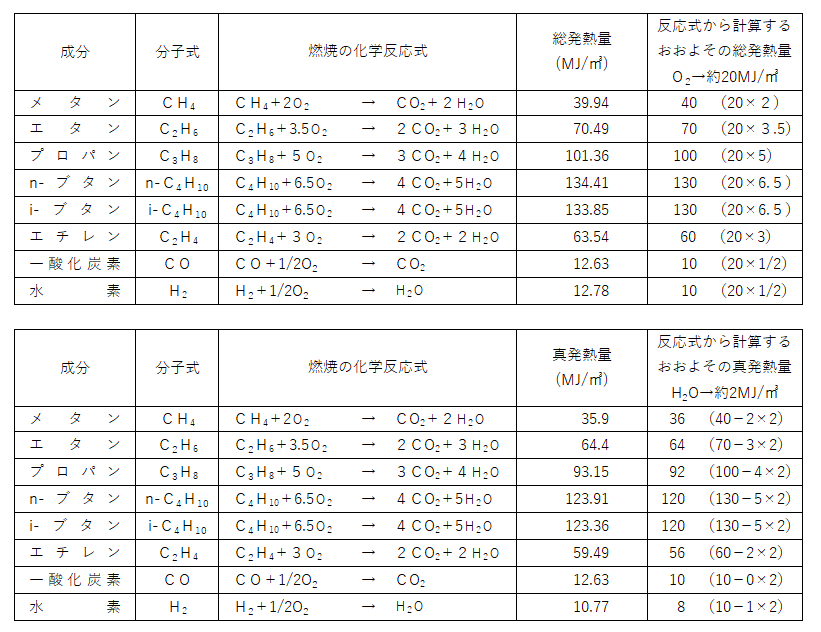
※燃焼の化学反応式で例えばエタンなら本来2C2H6+6O2→4CO2+6H2O
となるところですが、1molあたりで計算したかったので、+3.5O2となっています。
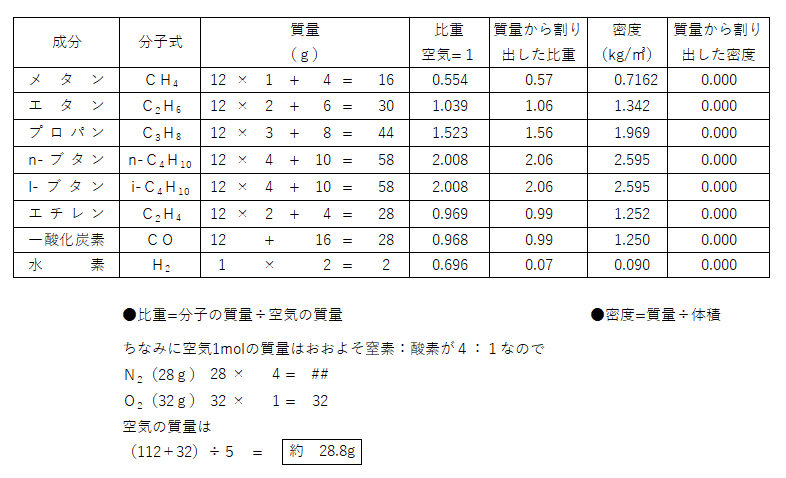
💡燃焼に必要な理論空気量は理論酸素量を4.76倍すると求められますが、計算するうえでは5倍でおおよその理論空気量が分かると思います(試験においては、簡単に求めることが大切だと思います)
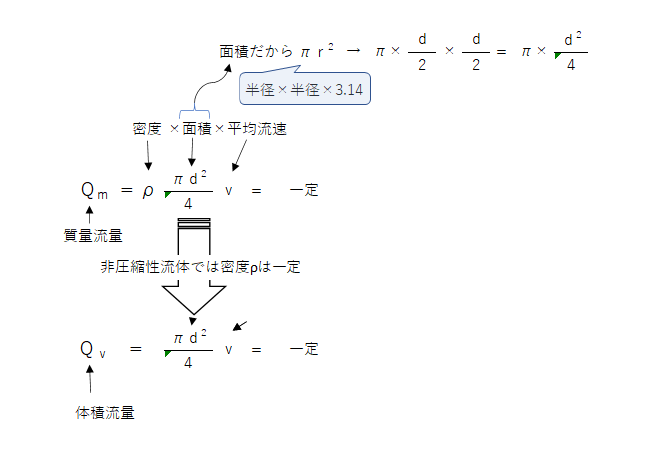
流体力学
質量保存の法則:断面積が変化する円管において各断面を単位時間に通る流体の質量は変わらない
伝熱
熱伝導
フーリエの法則
Wikipediaより
単位時間に単位面積を流れる熱流(熱流束密度)を J [W/m2] とし、温度を T とすると、分子論的熱緩和時間より十分長い時間(定常状態と見なせる時間)領域での現象に対して、熱流束密度 J は温度勾配 grad T に比例する。
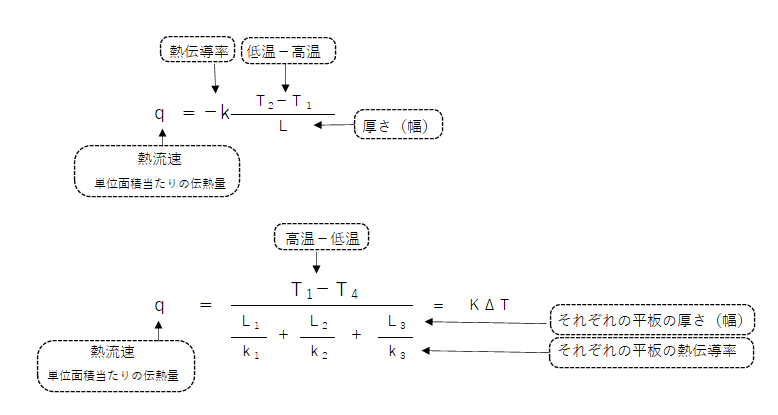
【例題】
熱伝導率0.9W(m・K)の耐火レンガ230mmと、同じく0.09W(m・K)の断熱材100mmを積層した炉壁がある。この炉壁の内面温度を1000℃、外面温度80℃とした場合、炉壁の熱流束[W/㎡]を求めよ。
出典:一般社団法人日本ガス協会 都市ガス工業概要(基礎理論編)より
**解答**
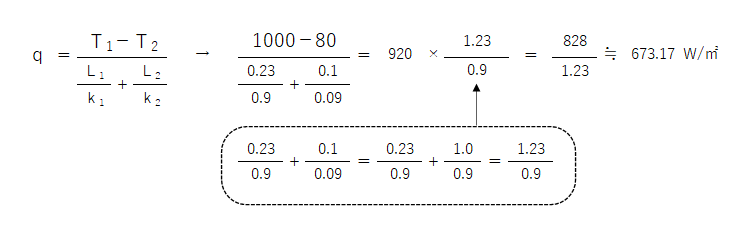
答えは 673W/㎡
熱通過率
熱交換器の熱エネルギー量

【ガス主任技術者 平成25年度 甲種基礎問題 問13】
平板で隔てた燃焼ガスと水との間の伝熱において、燃焼ガス温度920℃、水温度120℃、平板の厚さ10㎜、平板の熱伝導率48W/(m・K)、燃焼ガス側の熱伝達率480W/(㎡K)、水側の熱伝達率4800W/(㎡K)のとき、平板面積1㎡を通過する熱流束(kw/㎡)の値として最も近い値はどれか。
(1) 20 (2) 40 (3) 80 (4) 160 (5) 320
**解答**
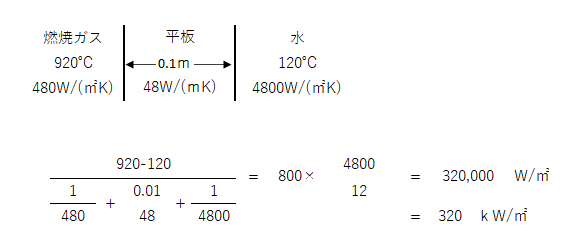
答えは (5)



コメント